
Diferenciais de Nintedanibe comparado a Pirfenidona no tratamento da FPI: carta médica
18 Dez 2021

Estudos de Fase 3 para aprovação pelas agências regulatórias:
- Nintedanibe teve um único estudo de fase 3, que foi suficiente para sua aprovação pelo FDA. INPULSIS® : único estudo de dois grupos paralelos com resultados consistentes no desfecho primário. N=1051 pacientes, quase o dobro de pacientes envolvidos no ASCEND®;
- Recentemente, o nintedanibe teve ainda aprovação adicional de uso em pacientes com doença pulmonar intersticial associado à esclerose sistêmica, através do estudo fase 3, SENSCIS, com N=576 pacientes12.
- Pirfenidona teve 4 estudos de Fase 3: 1) um estudo japonês, com N= 275 pacientes. 2 e 3) CAPACITY® : dois grupos paralelos, com um N total de 779 pacientes. Em um dos grupos, o resultado de eficácia (desfecho primário) não foi atingido. 4)Por fim o ASCEND® , estudo de grupo único, N= 555 pacientes.
Mecanismo de ação
- Nintedanibe: Mecanismo de ação conhecido: Nintedanibe é um inibidor de tirosina quinase específico, que bloqueia pouco mais de 250 quinases. Foi originalmente desenvolvido como droga anti-neoplásica com objetivo de inibir VEGFR2 e, portanto, a neoangiogenese. Entretanto, foi observado que a especificidade de nintedanibe também trataria doenças fibróticas como fibrose pulmonar idiopática, já que muitas das quinases alvo de nintedanibe estão envolvidas na patogênese da fibrose. Através da ligação intracelular no sítio de ligação de ATP dos receptores de FGF, PDGF e VEGF, nintedanibe bloqueia suas cascatas de sinalização, que quando ativadas, levam à proliferação, migração e sobrevivência de fibroblastos e miofibroblastos. Nintedanibe também bloqueia quinases da família Src, envolvidas em inflamação e ativação imunológica.
Eficácia na redução de risco de exacerbação aguda
- Nintedanibe é a única das drogas antifibróticas aprovadas cujo estudo de aprovação (INPULSIS 1 e 2) incluiu "tempo até primeira exacerbação aguda" como desfecho secundário chave.
- Nintedanibe apresentou redução relativa de 47% no risco da primeira exacerbação aguda em comparação ao placebo (análise combinada TOMORROW® e INPULSIS®).
- Ofev® oferece uma melhora significativa em exacerbações agudas em comparação com placebo; Esbriet não demonstrou isso em ensaios Fase III. Os ensaios Fase II não demonstraram diferença significativa com relação ao placebo.
Eficácia em diferentes perfis
- Eficácia em diferentes perfis de pacientes. O nintedanibe, através do estudos INPULSIS apresentou critérios mais amplos de inclusão de pacientes como, por exemplo, permitiu a inserção de pacientes com padrão PIU provável. Como critérios de HRCT formam a base de um diagnóstico de FPI; com base neles, a população do ensaio clínico de Ofev é mais diversificada do que a vista em ensaios de Esbriet. Além disso, os estudos clíni- cos com nintedanibe também incluíram pacientes sem teto de Capacidade Vital Forçada (CVF) e sem limite de idade, além de ser o único estudo entre os antifibróticos a inserir 40% de pacientes com combinação de fibrose pulmonar e enfisema (CPFE), apresentando eficácia também nestes pacientes.13,14,15
Abrangência da população de estudo:
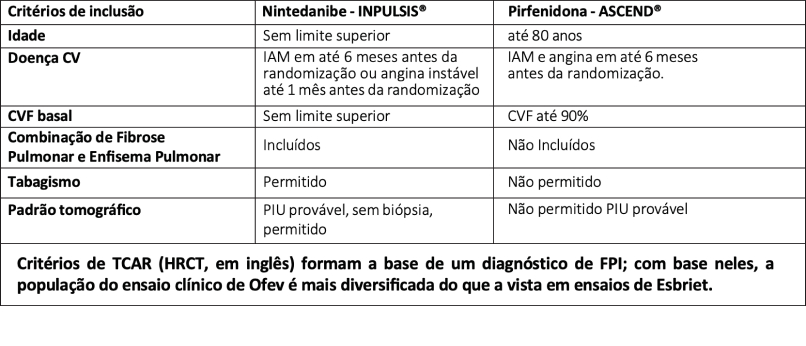
Nintedanibe tem evidências de consistência no resultado de eficácia independentemente de:
- Idade <65anos ou ≥65 anos;
- CVF inicial ≤70% do predito ou >70% do predito;
- CVF inicial ≤90% do predito ou >90% do predito;
- Presença ou não de faveolamento na TCAR;
- Presença de enfisema no screening;
- Uso de antiácido.
Qualidade de vida
Pacientes com FPI mais grave tiveram consistentemente menos deterioração na QoL ao longo de um grupo de medidas de QoL em INPULSIS-1 & -2, em comparação com placebo; nenhuma diferença foi observada para pacientes com doença menos grave1. Uma deterioração significativamente menor em SGRQ também foi observada na população geral em uma análise agrupada dos ensaios de TOMORROW e INPULSIS3.
Em relação aos dados da pirfenidona, o SGRQ foi incluído nos ensaios de CAPACITY; entretanto, os resultados não foram apresentados para domínio público. Em síntese, pacientes com FPI mais grave têm deterioração significativamente menor na QoL com Ofev versus placebo; Esbriet não tem dados sobre QoL.
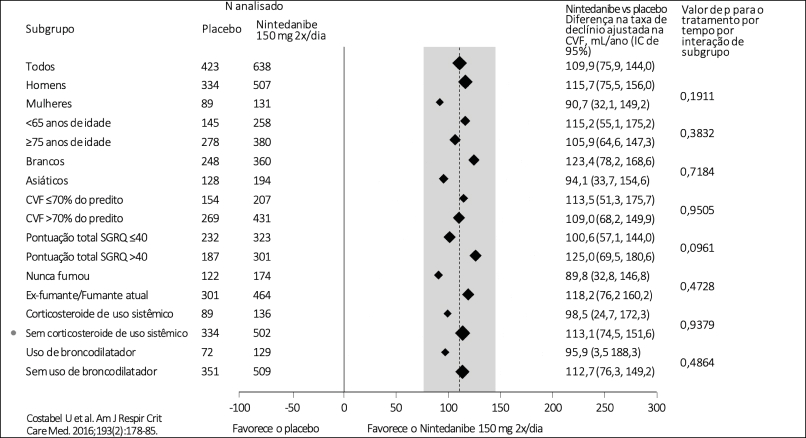
Redução de dose
- Nintedanibe possui dados de manutenção de eficácia mesmo com redução de dose para 100 mg 2x/dia ou mesmo interrupção transitória do tratamento devido a eventos adversos
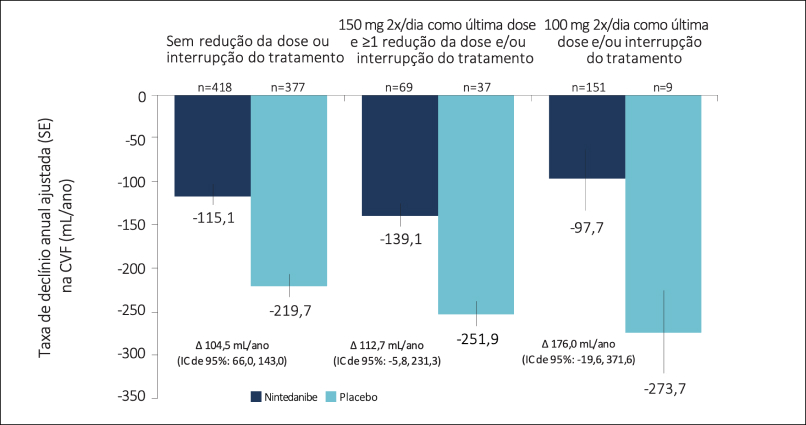
Reduções da dose e interrupções do tratamento nos estudos INPULSIS®
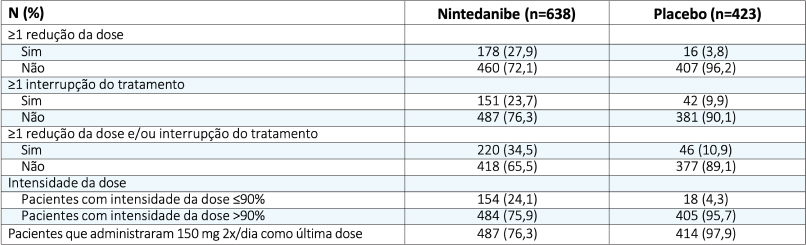
Variação da CVF basal em pacientes tratados com nintedanibe
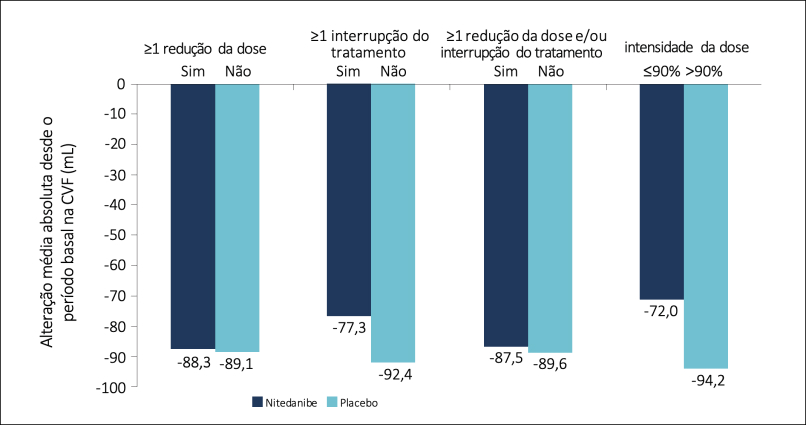
- O declínio de CVF foi semelhante entre os grupos, independentemente da redução de dose de 150mg para 100mg, ou mesmo de interrupção momentânea do tratamento.
INPULSIS®: taxa de declínio anual na CVF por ajuste da dose
Maher TM et al. Poster presented at the American Thoracic Society International Conference, Washington, DC, USA, 19-24 May 2017.
- O efeito de eficácia foi consistente entre os 3 subgrupos, independentemente de redução de dose e/ou interrupção do tratamento. p de interação = 0,7765.
- Pirfenidona não possui evidências robustas em relação a manutenção de eficácia para a dose de 6 comprimidos, tampouco para a de 3 comprimidos.
Perfil de interações medicamentosa
- Nintedanibe possui perfil favorável de interações medicamentosas. Por não inibir ou induzir as enzimas CYP (citocromo P450) em estudos pré-clínicos, é baixa a probabilidade de interações medicamentosas com fármacos metabolizados por esta via;
- Inibidores do componente CYP1A2 do citocromo P450 podem aumentar exposição à pirfenidona e facilitar sua toxicidade: Antidepressivos IRSS, como por exemplo, fluvoxamina. Outros agentes: cimetidina, ciprofloxacina;
- Indutores do componente CYP1A2, do citocromo P450, podem reduzir exposição à pirfenidona e diminuir seu efeito terapêutico, como recomendado em bula. Inibidores de bomba de prótons, como por exemplo omeprazol, pantoprazol;
OBS: como a DRGE é uma comorbidade frequente nos pacientes com FPI, é vantajoso um antifibrótico que não tenha interação com IBP.
Perfil de segurança7,21
- Principais eventos adversos de nintedanibe: Diarreia, náuseas e vômitos.
- Principais eventos adversos de Pirfenidona: náuseas e rash cutâneo. Em um país ensolarado como o Brasil, o evento adverso de rash tem impacto importante.
- OFEV® conta com dados sobre segurança publicados para até 68 meses de tratamento; Esbriet tem dados publicados até 24 meses.
- Nintedanibe é o único dos antifibróticos com estudo de segurança em pacientes brasileiros.
Posologia
- Nintedanibe: 150mg (cápsula única) 12/12h preferencialmente ingerido com alimentos.
- Pirfenidona: cápsulas gelatinosas duras de 267mg.
Posologia:
Dias 1 a 7: uma cápsula 3X/dia Dias 8 a14: duas cápsulas 3x/dia
Dias 15 em diante: três cápsulas 3X/dia
Necessidade de titulação da dose no início do tratamento com pirfenidona
Eficácia a longo prazo:
- Nintedanibe tem dados de manutenção de eficácia em 4 anos, tanto no retardo da progressão da FPI, como na redução do risco de exacerbações agudas. Dados do INPULSIS-ON®;
- Pirfenidona não tem dados robustos sobre eficácia a longo prazo, e de acordo com Dempsey et al (2019), parece perder eficácia na redução de mortalidade após 2 anos de uso.
Contribuição com Pesquisa e Desenvolvimento:22-25

Outros ensaios clínicos em FPI
- INMARK - Biomarcadores para progressão da doença em FPI1
- INSTAGE - Ofev com terapia de combinação de sildenafila em comparação com Ofev sozinho em pacientes com FPI grave (N=274)2

Outros ensaios clínicos em DPI
- SENSCIS - Ofev versus placebo em DPI-ES (N=576)3
- INBUILD - Ofev versus placebo em DPI-FP (N=600)4

Registro de pacientes
- Apoio a registro de pacientes com FPI em diversos países
Expansão das indicações:5,26
- Nintedanibe também é aprovado para tratamento da doença pulmonar intersticial associada à esclerose sistêmica (DPI-ES)
Prestação de Serviço
A Boehringer Ingelheim oferece diversos serviços para auxiliar o manejo da FPI, tanto para o profissional de saúde, quanto para o paciente:
Dados na População Brasileira
- Nintedanibe apresentou um perfil aceitável de segurança em pacientes portadores de FPI brasileiros incluídos no acesso expandido consistentes com dados encontrados nos ensaios clínicos16.
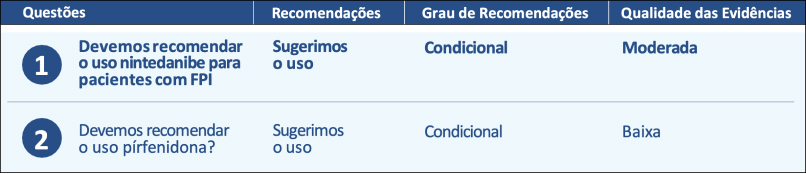
Diretrizes brasileiras para o tratamento farmacológico da Fibrose Pulmonar Idiopática.
Documento oficial da Sociedade Brasileira de Pneumologia e Tisiologia baseado na metodologia GRADE
- Nintedanibe: seis revisões sistemáticas com meta-análises selecionadas, demonstrando um efeito terapêutico benéfico do nintedanibe nos pacientes com FPI em comparação a placebo. Em relação ao desfecho queda da capacidade vital forçada (CVF), nintedanibe mostrou benefício, com OR estimada para quedas maiores que 10% de 0,61 (IC95%: 0,48-0,78), com qualidade da evidência alta. O fármaco também é eficaz quanto à redução do número de exacerbações agudas (OR = 0,50; IC95%: 0,31-0,79), com qualidade da evidência moderada.
- Pirfenidona: reduziu mortalidade - risco relativo (RR) = 0,53; IC95%: 0,32-0,88- com qualidade de evidência moderada. Eficaz em reduzir a queda de CVF > 10% (RR = 0,64; IC95%: 0,50-0,83). Quanto ao desfecho de redução do número de exacerbações agudas, não foi observado resultado estatisticamente significante (RR = 0,59; IC95%: 0,19-1,84), com qualidade de evidência baixa.
Resumo das recomendações para o tratamento medicamentoso com antifibrótico da fibrose pulmonar idiopática:16
Referências
-
1.
Taniguchi H, Ebina M, Kondoh Y, et al. Pirfenidone in idiopathic pulmonary fibrosis: a phase III clinical trial in Japan. Eur Respir J, 35 (2010), pp. 821-829.
-
2.
Noble, Paul W., et al. "Pirfenidone in patients with idiopathic pulmonary fibrosis (CAPACITY): two randomised trials." The Lancet 377.9779 (2011): 1760-1769.
-
3.
King Jr, Talmadge E., et al. "A phase 3 trial of pirfenidone in patients with idiopathic pulmonary fibrosis." New England Journal of Medicine 370.22 (2014): 2083-2092.
-
4.
Richeldi, Luca, et al. "Efficacy and safety of nintedanib in idiopathic pulmonary fibrosis." New England Journal of Medicine 370.22 (2014): 2071-2082.
-
5.
Bula Ofev® aprovada pela ANVISA em 02/12/2019.
-
6.
Bula Esbriet® aprovada pela ANVISA em 13/12/2019.
-
7.
Crestani, Bruno, et al. "Long-term safety and tolerability of nintedanib in patients with idiopathic pulmonary fibrosis: results from the open-label extension study, INPULSIS-ON." The Lancet Respiratory Medicine 7.1 (2019): 60-68.
-
8.
Dempsey, Timothy M., et al. "Clinical Effectiveness of the Anti-Fibrotic Medications for Idiopathic Pulmonary Fibrosis." American Journal of Respiratory and Critical Care Medicine ja (2019).
-
9.
Pereira, Carlos Alberto de Castro, Baddini-Martinez J. A., Baldi, B. G. et al. "Segurança e tolerabilidade de Nintedanibe em pacientes com fibrose pulmonar idiopática no Brasil." J Bras Pneumol. 2019;45(5):e20180414.
-
10.
Richeldi L, et al. based on the poster presented at PFF Summit 2015, Washington, DC, USA, 12-14 November 2015.
-
11.
Maher TM, et al. Differences in Patient and Physician Viewpoints of the Management of Idiopathic Pulmonary Fibrosis. ATS 2017, 113th Int Conf of the American Thoracic Society (ATS), Washington, 19-24 May 2017 (Poster).
-
12.
Distler O, Highland KB, Gahlemann M, et al. Nintedanib for Systemic Sclerosis-Associated Interstitial Lung Disease. N Engl J Med. 2019; Bula profissional de Ofev® (esilato de nintedanibe). Versão aprovada pela ANVISA em 17Dez2019.)
-
13.
Richeldi L, Du bois RM, Raghu G, et al. Efficacy and safety of nintedanib in idiopathic pulmonary fibrosis. N Engl J Med. 2014;370(22):2071-82.
-
14.
Raghu G, Wells AU, Nicholson AG, et al. Effect of Nintedanib in Subgroups of Idiopathic Pulmonary Fibrosis by Diagnostic Criteria. Am J Respir Crit Care Med. 2017;195(1):78-85.
-
15.
Cottin V, Azuma A, Raghu G, et al. Therapeutic effects of nintedanib are not influenced by emphysema in the INPULSIS trials. Eur Respir J. 2019;53(4).
-
16.
Pereira, Carlos Alberto de Castro, Baddini-Martinez J. A., Baldi, B. G. et al. "Segurança e tolerabilidade de Nintedanibe em pacientes com fibrose pulmonar idiopática no Brasil." J Bras Pneumol. 2019;45(5):e20180414.
-
17.
Aravena C, Labarca G, Venegas C, Arenas A, Rada G. Pirfenidone for Idiopathic Pulmonary Fibrosis: A Systematic Review and Meta-Analysis. Plos one. 2015;10(8):e0136160.
-
18.
KREUTER, Michael, et al. Health-related quality of life and symptoms in patients with IPF treated with nintedanib: analyses of patient-reported outcomes from the INPULSIS® trials. Respiratory Research, 2020, vol. 21, no 1, p. 36.
-
19.
Jones PW, Beeh KM, Chapman KR, Decramer M, Mahler DA, Wedzicha JA. Minimal clinically important differences in pharmacological trials. American journal of respiratory and critical care medicine. 2014;189(3):250-5.
-
20.
Richeldi L, Cottin V, du Bois RM, Selman M, Kimura T, Bailes Z, et al. Nintedanib in patients with idiopathic pulmonary fibrosis: Combined evidence from the TOMORROW and INPULSIS((R)) trials. Respiratory medicine. 2016;113:74-9.
-
21.
Cottin V, Koschel D, Gunther A, Albera C, Azuma A, Skold CM, et al. Long-term safety of pirfenidone: results of the prospective, observational PASSPORT study. ERJ open research. 2018;4(4).
-
22.
Distler O, Highland KB, Gahlemann M, Azuma A, Fischer A, Mayes MD, et al. Nintedanib for Systemic Sclerosis-Associated Interstitial Lung Disease. The New England journal of medicine. 2019;380(26):2518-28.
-
23.
Flaherty KR, Brown KK, Wells AU, Clerisme-Beaty E, Collard HR, Cottin V, et al. Design of the PF-ILD trial: a double-blind, randomised, placebo-controlled phase III trial of nintedanib in patients with progressive fibrosing interstitial lung disease. BMJ Open Respir Res. 2017;4(1):e000212-e.
-
24.
Maher TM, Stowasser S, Nishioka Y, White ES, Cottin V, Noth I, et al. Biomarkers of extracellular matrix turnover in patients with idiopathic pulmonary fibrosis given nintedanib (INMARK study): a randomised, placebo-controlled study. The Lancet Respiratory medicine. 2019;7(9):771-9.
-
25.
Kolb M, Raghu G, Wells AU, Behr J, Richeldi L, Schinzel B, et al. Nintedanib plus Sildenafil in Patients with Idiopathic Pulmonary Fibrosis. The New England journal of medicine. 2018;379(18):1722-31.
-
26.
Distler O, Highland KB, Gahlemann M, Azuma A, Fischer A, Mayes MD, et al. Nintedanib for Systemic Sclerosis-Associated Interstitial Lung Disease. The New England journal of medicine. 2019;380(26):2518-28.


