JARDIANCE®
(Empagliflozina)
Eficácia
Efeitos sobre a hemoglobina glicada (HbA1c)
- Pacientes com níveis de HbA1c de ≥7% a ≤10% (≥53 a ≤86 mmol/mol), enquanto recebiam metformina (≥1.500 mg/dia), foram randomizados e tratados uma vez ao dia com empagliflozina 10 mg (n=217), empagliflozina 25 mg (n=213) ou placebo (n=207), por 24 semanas.11
- O desfecho primário foi a mudança no nível de HbA1c em relação aos valores basais na semana 24. Os desfechos secundários importantes foram alterações desde o início do estudo no peso e glicemia média diária na semana 24.11
- Reduções no nível da HbA1c na semana 24 foram significativamente maiores nos grupos com empagliflozina do que no grupo placebo. As diferenças nos valores médios ajustados versus placebo foram de -0,57% para empagliflozina 10 mg (intervalo de confiança [IC] de 95%: -0,70 a -0,43) (-6,2 mmol/mol [IC de 95%: -7,7 a -4,7]) e de -0,64% para empagliflozina 25 mg (IC de 95%: -0,77 a -0,50) (-7,0 mmol/mol [IC de 95%: -8,4 a -5,5]); p<0,001 para ambas as doses.11
- Em outros estudos, a empagliflozina (10 e 25 mg 1x/dia) foi comparada ao placebo em monoterapia ou em associação a outros agentes anti-hiperglicemiantes orais ou insulina.12-16
Efeitos sobre o peso
Jardiance® não é indicado para perda de peso e redução da pressão arterial (PA).
- O estudo randomizou 1.364 pacientes com DM2 virgens de tratamento (HbA1c >7,5 a 12% [>58 a <108 mmol/mol]) por 24 semanas, comparando a eficácia e a segurança das combinações iniciais de empagliflozina + metformina com empagliflozina e metformina em monoterapia em pacientes com DM2.17
- O desfecho primário foi a mudança da linha de base na HbA1c na semana 24.17
- Nos grupos de tratamento randomizados, houve mudança pronunciada do peso basal na semana 24 com regimes de empagliflozina + metformina duas vezes ao dia (variação de -2,8 a -3,8 kg), que pareciam ser aditivos, dadas as mudanças no peso observadas com a empagliflozina uma vez ao dia (-2,4 kg para ambos os regimes).17
- Reduções da linha de base na PA (média inicial de 126,3 mmHg) na semana 24 variaram de -2,2 a 3,2 mmHg com regimes de empagliflozina + metformina duas vezes ao dia e de -2,1 a -2,3 mmHg com regimes de empagliflozina uma vez ao dia. Empagliflozina + metformina duas vezes ao dia reduziu significativamente a PA, em comparação com a metformina duas vezes ao dia, mas não foi comparada com os regimes de empagliflozina uma vez ao dia.17
As diferenças médias ajustadas nas alterações em relação ao valor basal com empagliflozina + metformina duas vezes ao dia, em comparação com a metformina duas vezes ao dia, variaram de -2,8 a -4,0 mmHg (p<0,05).17
Segurança cardiovascular e renal
- EMPEROR-Reduced Trial19
Foi um estudo duplo-cego, randomizado, controlado com placebo, em 3.730 pacientes diabéticos ou não com IC classe II, III ou IV e uma FE de 40% ou menos para receber empagliflozina (10 mg uma vez ao dia) ou placebo, além da terapia recomendada.
A finalidade era inscrever pacientes com IC com risco aumentado de um evento grave de IC. Assim, o número de pacientes com FE superior a 30% foi limitado, exigindo um histórico de hospitalização por IC nos últimos 12 meses ou um nível alto de NT-proBNP, incluindo um nível de pelo menos 1.000 pg/mL quando a FE era de 31% a 35% ou um nível de pelo menos 2.500 pg/mL naqueles com FE de 36% a 40%, em comparação com um nível de pelo menos 600 pg/mL naqueles com FE de 30% ou menos.18 Esses limiares de NT-proBNP foram duplicados em pacientes com fibrilação atrial.19
Desfecho primário – Foi um composto de morte cardiovascular ou hospitalização por piora da IC.
Desfecho secundário – O primeiro desfecho secundário foi a ocorrência de todas as hospitalizações por IC, incluindo eventos iniciais e recorrentes. O segundo desfecho secundário foi o declínio da taxa de filtração glomerular (TFG) estimada durante o tratamento duplo-cego.
Resultados – Durante seguimento mediano de 16 meses:
– O desfecho primário ocorreu em 361 de 1.863 pacientes (19,4%) no grupo de empagliflozina e em 462 de 1.867 pacientes (24,7%) no grupo de placebo (razão de risco para morte cardiovascular ou hospitalização por IC: 0,75; IC de 95%: 0,65 a 0,86; p<0,001). (Figura 1) Esse efeito da empagliflozina foi consistente em pacientes, independentemente da presença ou ausência de diabetes.
Figura 1. Desfecho primário e hospitalizações totais por insuficiência cardíaca
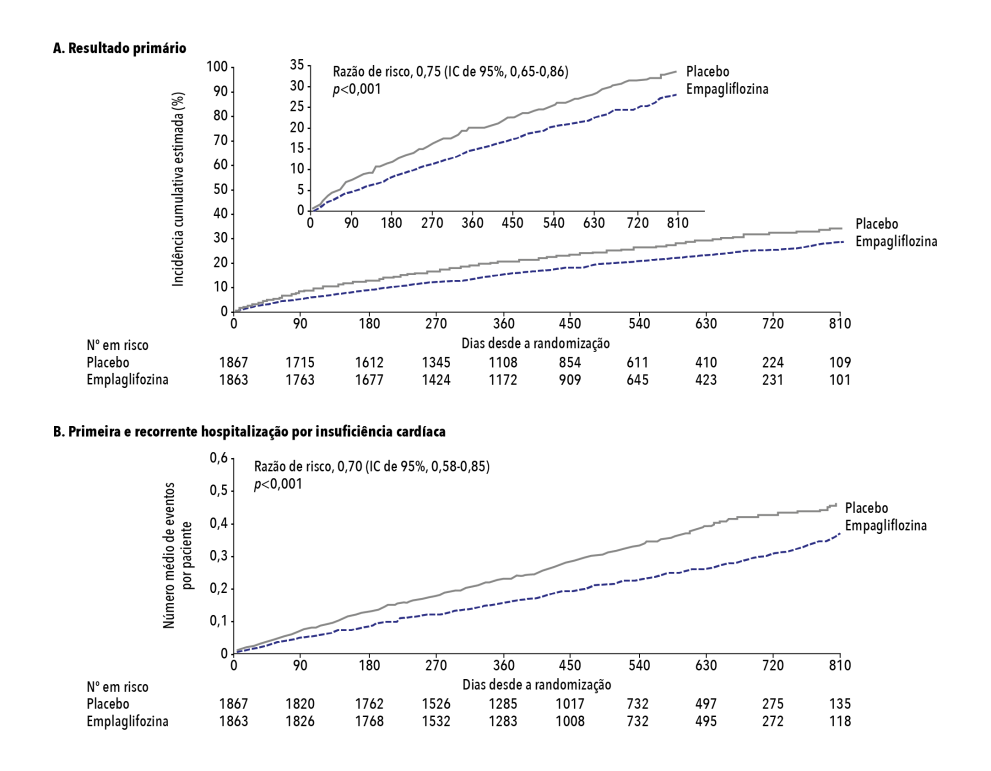
Adaptada de: Packer M, et al. N Engl J Med. 2020;383(15):1413-24.8
– O número total de hospitalizações por IC foi significativamente menor no grupo da empagliflozina do que no grupo do placebo (razão de risco: 0,70; IC de 95%: 0,58 a 0,85; p<0,001).
– Quanto ao desfecho renal, a taxa anual de declínio na TFG estimada foi mais lenta no grupo da empagliflozina do que no grupo do placebo (-0,55 vs. -2,28 mL por minuto por 1,73 m2 de área de superfície corporal por ano, p<0,001) e pacientes tratados com empagliflozina tiveram um risco menor de desfechos renais graves. (Figura 2)
Figura 2. Mudanças na taxa estimada de filtração glomerular8
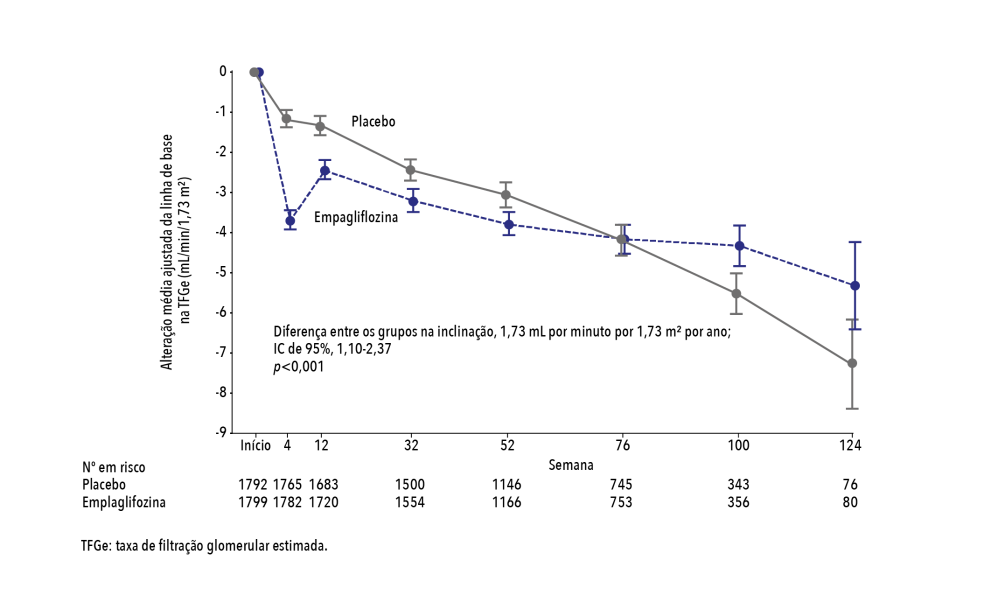
Adaptada de: Packer M, et al. N Engl J Med. 2020;383(15):1413-24.8
- EMPA-REG Outcome1
Foi um estudo randomizado, duplo-cego, controlado com placebo, em 7.020 pacientes com DM2 e alto risco cardiovascular, que receberam empagliflozina (10 mg ou 25 mg) ou placebo uma vez ao dia.1
Os pacientes elegíveis apresentavam IMC de ≤45 TFGe de pelo menos 30 mL/min/1,73 m2 . Todos os pacientes tinham doença cardiovascular estabelecida, não receberam agentes redutores de glicose por pelo menos 12 semanas antes da randomização e apresentavam um nível de hemoglobina glicada de pelo menos 7% e não mais do que 9% ou receberam terapia de redução de glicose por pelo menos 12 semanas antes da randomização e apresentavam um nível de hemoglobina glicada de pelo menos 7% e não mais do que 10%.1
Desfecho primário – Foi composto de morte por causas cardiovasculares, infarto do miocárdio não fatal ou acidente vascular cerebral não fatal.
Desfecho secundário – O principal desfecho composto secundário foi o desfecho primário mais a hospitalização por angina instável.
Resultados – Durante o seguimento de 3,1 anos:
- O desfecho primário ocorreu em 10,5% dos pacientes no grupo de empagliflozina e em 12,1% no grupo placebo (RR: 0,86; IC de 95%: 0,74 a 0,99; p =0,04 para superioridade). (Figura 3)
Figura 3. Incidência cumulativa do desfecho primário (morte por causas cardiovasculares, infarto do miocárdio não fatal ou acidente vascular cerebral não fatal)
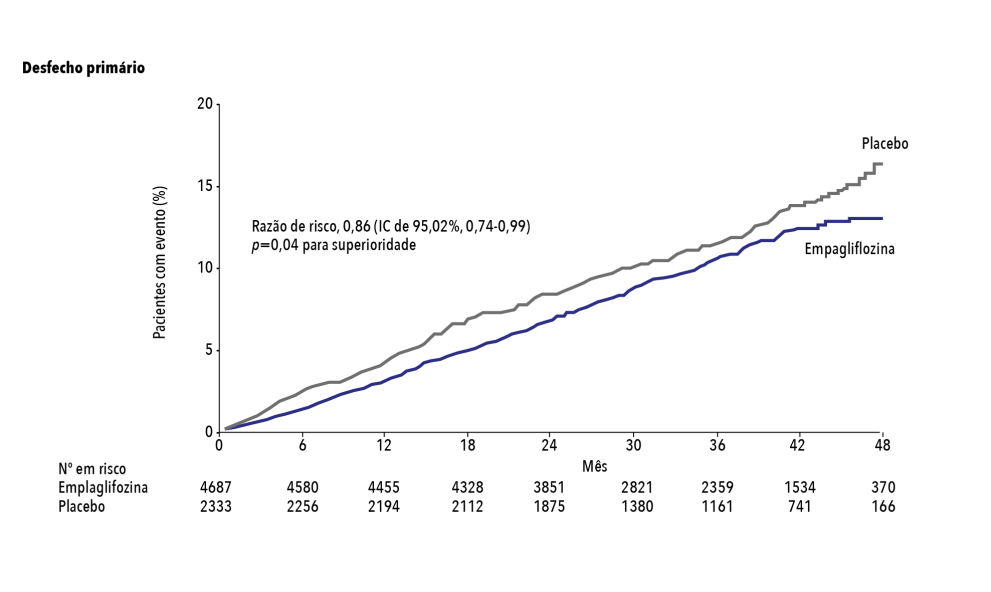
Adaptada de: Zinman B, et al. N Engl J Med. 2015;373(22):2117-28.1
- Não houve diferenças significativas entre os grupos nas taxas de infarto do miocárdio ou AVC, mas no grupo da empagliflozina houve taxas significativamente mais baixas de morte por causas cardiovasculares (3,7% vs. 5,9% no grupo do placebo; 38% de redução do risco relativo), hospitalização por insuficiência cardíaca (2,7% e 4,1%, respectivamente; redução do risco relativo de 35%) e morte por qualquer causa (5,7% e 8,3%, respectivamente; redução do risco relativo de 32%).
ol.gds-ordered a { text-decoration: underline !important; }Referências bibliográficas
-
Zinman B, Wanner C, Lachin JM, Fitchett D, Bluhmki E, Hantel S, et al.; EMPA-REG OUTCOME Investigators. Empagliflozin, cardiovascular outcomes, and mortality in type 2 diabetes. N Engl J Med. 2015;373(22):2117-28.
-
Neal B, Perkovic V, Mahaffey KW, de Zeeuw D, Fulcher G, Erondu N, et al.; CANVAS Program Collaborative Group. Canagliflozin and cardiovascular and renal events in type 2 diabetes. N Engl J Med. 2017;377(7):644057.
-
Wiviott SD, Raz I, Bonaca MP, Mosenzon O, Kato ET, Cahn A, et al.; DECLARE-TIMI 58 Investigators. Dapagliflozin and cardiovascular outcomes in type 2 diabetes. N Engl J Med. 2019;380(4):347-57.
-
Perkovic V, Jardine MJ, Neal B, Bompoint S, Heerspink HJL, Charytan DM, et al.; CREDENCE Trial Investigators. Canagliflozin and renal outcomes in type 2 diabetes and nephropathy. N Engl J Med. 2019;380(24):2295-306.
-
Fitchett D, Zinman B, Wanner C, Lachin JM, Hantel S, Salsali A, et al.; EMPA-REG OUTCOME® Trial Investigators. Heart failure outcomes with empagliflozin in patients with type 2 diabetes at high cardiovascular risk: results of the EMPA-REG OUTCOME® trial. Eur Heart J. 2016;37(19):1526-34.
-
Fitchett D, Butler J, van de Borne P, Zinman B, Lachin JM, Wanner C, et al.; EMPA-REG OUTCOME® Trial Investigators. Effects of empagliflozin on risk for cardiovascular death and heart failure hospitalization across the spectrum of heart failure risk in the EMPA-REG OUTCOME trial. Eur Heart J. 2018;39(5):363-70.
-
Rådholm K, Figtree G, Perkovic V, Solomon SD, Mahaffey KW, de Zeeuw D, et al. Canagliflozin and heart failure in type 2 diabetes mellitus: Results From the CANVAS Program. Circulation. 2018;138(5):458-68.
-
Packer M, Anker SD, Butler J, Filippatos G, Pocock SJ, Carson P, et al.; EMPEROR-Reduced Trial Investigators. Cardiovascular and Renal Outcomes with Empagliflozin in Heart Failure. N Engl J Med. 2020;383(15):1413-24.
-
Bula profissional de Jardiance® (empagliflozina). Versão aprovada pela ANVISA em 29 de maio de 2024. Disponível em: https://consultas.anvisa.gov.br/#/bulario/q/?nomeProduto=JARDIANCE.
-
Tamargo J. Sodium-glucose cotransporter 2 inhibitors in heart failure: potential mechanisms of action, adverse effects and future developments. Eur Cardiol. 2019;14(1):23-32.
-
Häring HU, Merker L, Seewaldt-becker E, Weimer M, Meinicke T, Broedl UC, et al.; EMPA-REG MET Trial Investigators. Empagliflozin as add-on to metformin in patients with type 2 diabetes: a 24-week, randomized, double-blind, placebo-controlled trial. Diabetes Care. 2014;37(6):1650-9.
-
Roden M, Weng J, Eilbracht J, Delafont B, Kim G, Woerle HJ, et al.; EMPA-REG MONO trial investigators. Empagliflozin monotherapy with sitagliptin as an active comparator in patients with type 2 diabetes: a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Diabetes Endocrinol. 2013;1(3):208-19.
-
Kovacs CS, Seshiah V, Swallow R, Jones R, Rattunde H, Woerle HJ, et al.; EMPA-REG PIO™ trial investigators. Empagliflozin improves glycaemic and weight control as add-on therapy to pioglitazone or pioglitazone plus metformin in patients with type 2 diabetes: a 24-week, randomized, placebo-controlled trial. Diabetes Obes Metab. 2014;16(2):147-58.
-
Häring HU, Merker L, Seewaldt-becker E, Weimer M, Meinicke T, Woerle HJ, et al.; EMPA-REG METSU Trial Investigators. Empagliflozin as add-on to metformin plus sulfonylurea in patients with type 2 diabetes: a 24-week, randomized, double-blind, placebo-controlled trial. Diabetes Care. 2013;36(11):3396-404.
-
Rosenstock J, Jelaska A, Zeller C, Kim G, Broedl UC, Woerle HJ; EMPA-REG BASALTM trial investigators. Impact of empagliflozin added on to basal insulin in type 2 diabetes inadequately controlled on basal insulin: a 78-week randomized, double-blind, placebo-controlled trial. Diabetes Obes Metab. 2015;17(10):936-48.
-
Barnett AH, Mithal A, Manassie J, Jones R, Rattunde H, Woerle HJ, et al.; EMPA-REG RENAL trial investigators. Efficacy and safety of empagliflozin added to existing antidiabetes treatment in patients with type 2 diabetes and chronic kidney disease: a randomised, doubleblind, placebo-controlled trial. Lancet Diabetes Endocrinol. 2014;2(5):369-84.
-
Hadjadj S, Rosenstock J, Meinicke T, Woerle HJ, Broedl UC. Initial Combination of Empagliflozin and Metformin in Patients With Type 2 Diabetes. Diabetes Care. 2016;39(10):1718-28.
-
Ibrahim NE, Burnett JC Jr, Butler J, Camacho A, Felker GM, Fiuzat M, et al. Natriuretic peptides as inclusion criteria in clinical trials: a JACC: heart failure position paper. JACC Heart Fail. 2020;8(5):347-58.
-
Packer M, Butler J, Filippatos GS, Jamal W, Salsali A, Schnee J, et al.; EMPEROR-Reduced Trial Committees and Investigators. Evaluation of the effect of sodium-glucose co-transporter 2 inhibition with empagliflozin on morbidity and mortality of patients with chronic heart failure and a reduced ejection fraction: rationale for and design of the EMPEROR-Reduced trial. Eur J Heart Fail. 2019;21(10):1270-8.
Minibula
JARDIANCE comprimidos revestidos de 10 mg ou 25 mg – EMPAGLIFLOZINA – Indicações: Controle glicêmico: JARDIANCE é indicado para adultos para o tratamento do diabetes mellitus tipo 2 (DM2) para melhorar o controle glicêmico em conjunto comdieta e exercícios. Pode ser utilizado como monoterapia ou em associação com metformina, tiazolidinedionas, metformina mais sulfonilureia, ou insulina com ou sem metformina com ou sem sulfonilureia; Prevenção de eventos cardiovasculares: JARDIANCE é indicado para a prevenção de eventos cardiovasculares para pacientes com DM2 e doença cardiovascular estabelecida para reduzir o risco de mortalidade por todas as causas por reduzir a morte cardiovascular, morte cardiovascular ou hospitalização por insuficiência cardíaca; Insuficiência Cardíaca (IC): JARDIANCE é indicado para pacientes adultos com insuficiência cardíaca (Associação de Cardiologia de Nova Iorque - NYHA classe II-IV) com fração de ejeção reduzida (ICFEr), com ou sem diabetes mellitus tipo 2, para reduzir o risco de morte cardiovascular e hospitalizações por insuficiência cardíaca e retardar a perda da função renal. Posologia: administração oral, com ou sem alimentos; para DM2: a dose inicial recomendada é de 10 mg/dia ou máxima de 25 mg/dia; para IC: a dose recomendada é de 10 mg uma vez ao dia. Contraindicações: hipersensibilidade ou intolerância à empagliflozina, ou aos excipientes da fórmula. Cada comprimido de 10 mg contém 162,5 mg de lactose e cada comprimido de 25 mg contém 113 mg de lactose por dose máxima diária recomendada. Advertências e Precauções: não deve ser usado em pacientes com diabetes mellitus do tipo 1. JARDIANCE deve ser usado com cautela em pacientes com risco para cetoacidose diabética. Deve-se ter cuidado ao reduzir a dose de insulina. Em pacientes tratados com JARDIANCE, deve-se considerar o monitoramento da cetoacidose e a descontinuação temporária do JARDIANCE em situações clínicas conhecidas por predispor à cetoacidose (por exemplo, jejum prolongado devido a doença aguda ou cirurgia). Nessas situações, considere o monitoramento de cetonas, mesmo que o tratamento com JARDIANCE tenha sido interrompido. Casos de cetoacidose diabética com necessidade de hospitalização urgente incluindo casos fatais foram relatados em pacientes tratados com inibidores de SGLT-2, incluindo empagliflozina. Foram relatados casos pós- comercialização de fasciíte necrosante do períneo, uma infecção rara, porém grave e com risco de vida, em pacientes com diabetes em uso de inibidores de SGLT2, incluindo empagliflozina. Não é recomendado para uso em pacientes com DM2 e taxa de filtração glomerular <30 ml/min/1.73 m2 por sua eficácia ser dependente da função renal, em pacientes com IC e taxa de filtração glomerular <20 ml/min/1.73 m2, em pacientes pediátricos e adolescentes abaixo de 18 anos e em pacientes com idade maior ou igual a 85 anos devido a falta de dados de segurança e eficácia nessa população. A diurese osmótica que acompanha a glicosúria terapêutica pode levar a uma modesta redução na pressão arterial, portanto, recomenda-se precaução em pacientes em que isso possa representar risco. JARDIANCE está classificado na categoria B de risco na gravidez. Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista. Interações Medicamentosas: empagliflozina pode aumentar o efeito diurético de tiazídicos e diuréticos de alça e pode aumentar o risco de desidratação e hipotensão. A empagliflozina não teve interação clinicamente relevante quando coadministrada com metformina, glimepirida, pioglitazona, sitagliptina, linagliptina, varfarina, digoxina, ramipril, sinvastatina, hidroclorotiazida, torasemida e contraceptivos orais, em voluntários sadios. Reações adversas: hipoglicemia (em DM2, quando a empagliflozina é utilizada em associação com sulfonilureia ou em associação com insulina; em IC, quando o paciente também apresenta DM2), monilíase vaginal, vulvovaginite, balanite e outras infecções genitais, infecção do trato urinário, prurido, reações alérgicas de pele, como rash e urticária, e aumento de lipídeos séricos são comuns. Sede e micção aumentada são comuns em DM2 e incomuns em IC. Hipovolemia é muito comum em IC e incomum em DM2. São incomuns: disúria, aumento da creatinina sérica, taxa de filtração glomerular diminuída, aumento do hematócrito e cetoacidose. Reações com frequência desconhecida: em DM2, angioedema e fasciíte necrosante do períneo (gangrena de Fournier); em IC, cetoacidose. Registro: 25MG COM REV CT BL AL PLAS INCOLOR X 10 - 1.0367.0172.001-4, 25MG COM REV CT BL AL PLAS INCOLOR X 30 - 1.0367.0172.002-2, 10MG COM REV CT BL AL PLAS INCOLOR X 10 - 1.0367.0172.003-0, 10MG COM REV CT BL AL PLAS INCOLOR X 30 – 1.0367.0172.004-9. SAC 0800 701 663. VENDA SOB PRESCRIÇÃO MÉDICA. Em casos de eventos adversos, notifique pelo Sistema VigiMed, disponível no Portal da Anvisa.


