GLYXAMBI®
(empagliflozina/linagliptina)
Eficácia
Pacientes com diabetes mellitus tipo 2 (DM2) e controle glicêmico inadequado participaram de estudos clínicos duplos-cegos e randomizados para avaliar segurança e eficácia de Glyxambi®. Nos estudos, 1.005 pacientes foram tratados com Glyxambi® 10 mg ou 25 mg e linagliptina 5 mg. Os pacientes participantes dos estudos foram tratados por até 24 ou 52 semanas. [1]
Glyxambi® Adicionado à Metformina
Esse estudo clínico foi desenhado para avaliar a eficácia e a segurança de Glyxambi® como complemento à metformina em indivíduos com DM2 sem controle glicêmico adequado. A combinação de empagliflozina (10 mg ou 25 mg) e linagliptina (5 mg) resultou em uma redução significativa na hemoglobina glicada (HbA1c) e glicemia de jejum em comparação com os componentes individuais na semana 24. [3,4]
Desenho e Metódos
Os indivíduos foram randomizados para uma combinação de empagliflozina 25 mg/linagliptina 5 mg (n=137), empagliflozina 10 mg/linagliptina 5 mg (n=136), empagliflozina 25 mg (n=141), empagliflozina 10 mg (n=140) ou linagliptina 5 mg (n = 132) como complemento à metformina durante 52 semanas. O desfecho primário foi a mudança na HbA1c a partir do basal na semana 24. [4]
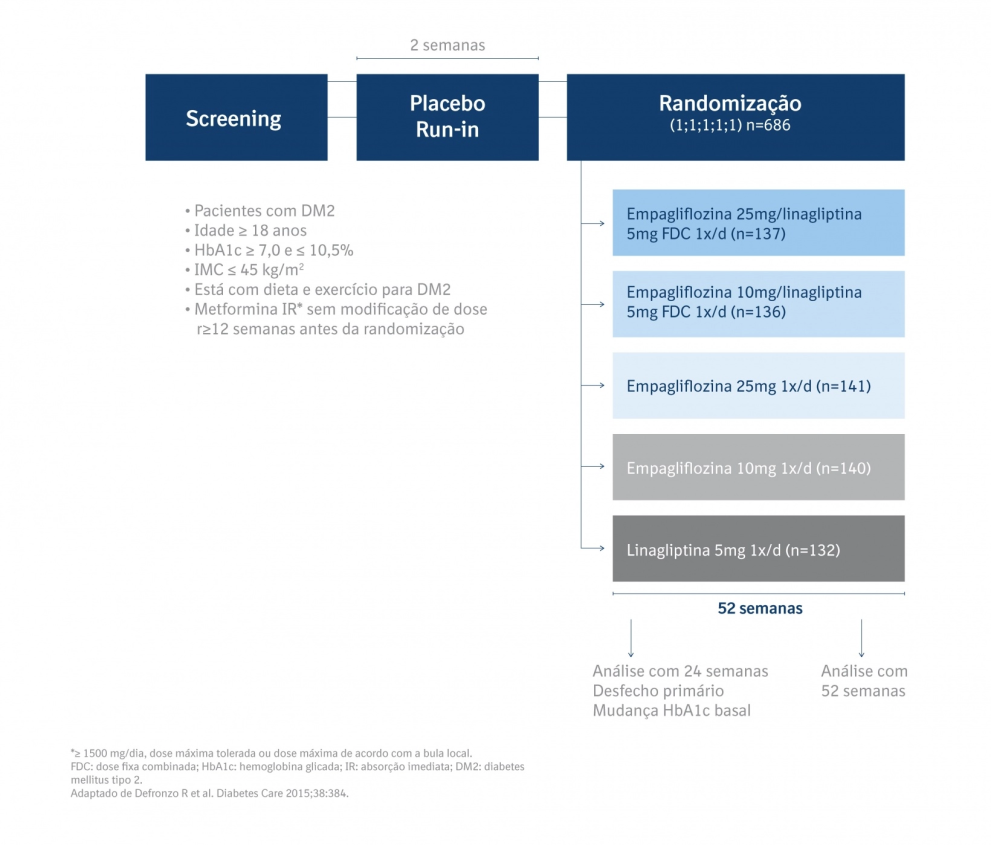
Critérios de inclusão: pacientes adultos com DM2, ≥ 18 anos, IMC ≤ 45 Kg/m2, HbA1c > 7 a ≤ 10,5% e com uso prévio de metformina. [4]
Critérios de exclusão: hiperglicemia não controlada (glicemia > 240 mg/dL após uma noite de jejum confirmada), tratamento com qualquer antidiabético que não metformina até 12 semanas antes da randomização, TFG < 60 mL/min/1,73 m2 (MDRD), síndrome coronariana aguda, acidente vascular cerebral ou ataque isquêmico transitório até 3 meses antes do consentimento informado, cirurgia bariátrica nos últimos 2 anos, uso de medicamentos para obesidade nos últimos 3 meses anteriores ao consentimento. [4]
Desfechos e Avaliações
Desfecho primário: alteração em relação à linha de base na HbA1c na semana 24. [4]
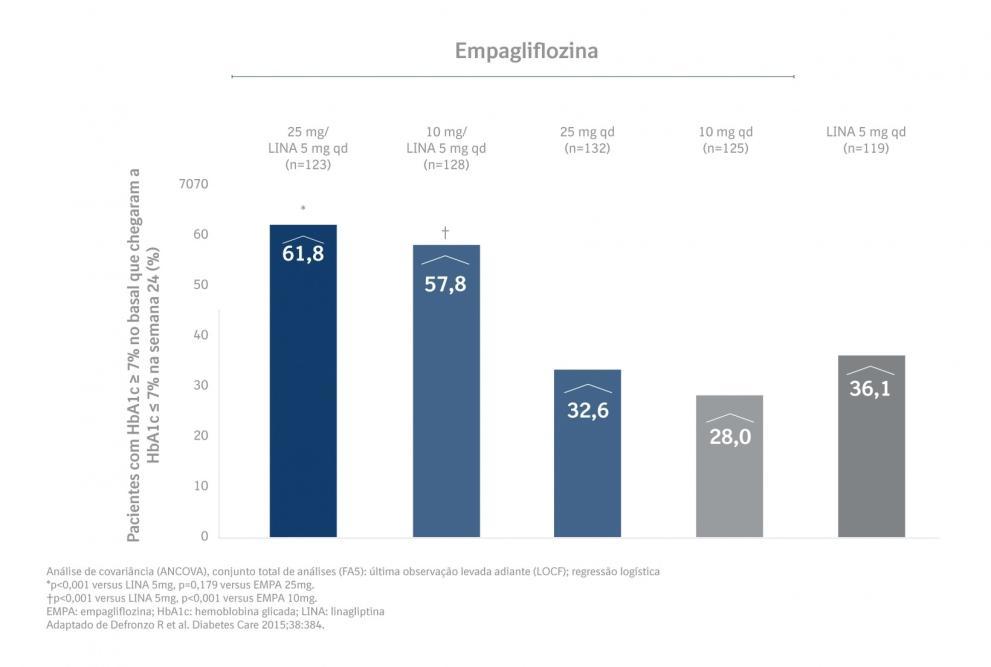
Principais desfechos secundários: alteração da linha de base na GJ na semana 24, alteração da linha de base no peso corporal na semana 24 e a proporção de indivíduos com HbA1c basal ≥ 7% que tiveram HbA1c < 7% na semana 24. [4]
Desfechos exploratórios: mudança da linha de base na HbA1c na semana 24 em subgrupos de indivíduos com HbA1c ≥ 8,5 e < 8,5% no início do estudo; mudança da linha de base na HbA1c, GJ, peso, pressão arterial sistólica (PAS) e pressão arterial diastólica (PAD) na semana 52; e a proporção de indivíduos com HbA1c basal ≥ 7% que tinham HbA1c < 7% na semana 52. [4]
Desfechos de segurança: sinais vitais, parâmetros laboratoriais clínicos e eventos adversos (EAs; termos preferenciais codificados de acordo com o Dicionário Médico para Atividades Regulatórias [MedDRA] versão 16.0). Os EAs incluíram todos os eventos com um início após a primeira dose e até 7 dias após a última dose da medicação do estudo. [4]
Resultados
Uma maior proporção de pacientes com HbA1c basal ≥ 7,0% e tratados com Glyxambi® conseguiu atingir um alvo de HbA1c < 7% em comparação com as substâncias ativas individuais. [4]
Após o tratamento de 24 semanas com empagliflozina/linagliptina, ambas as pressões sanguíneas sistólicas (PAS) e diastólica (PAD) foram reduzidas, -5,6/-3,6 mmHg (p <0,001 versus linagliptina 5 mg para PAS e PAD) para Glyxambi® 25 mg/5 mg e -4,1/-2,6 mmHg (p <0,05 versus linagliptina 5 mg para PAS, não significativo para PAD) para Glyxambi® 10 mg/5 mg. [4]
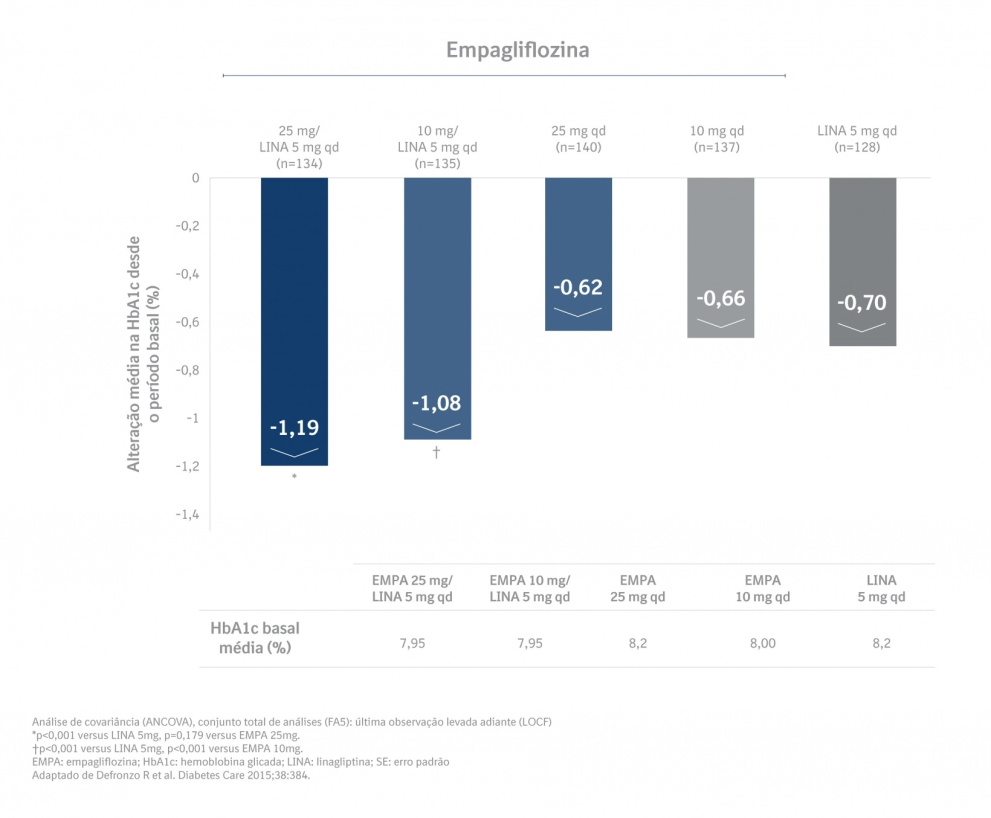
Foram observadas reduções clinicamente significativas na HbA1c (Figura 3) e nas pressões sanguíneas sistólica e diastólica na semana 52, -3,8/-1,6 mmHg (p <0,05 versus linagliptina 5 mg para PAS e PAD) para Glyxambi® 25 mg/5 mg e -3,1/-1,6 mmHg (p <0,05 versus linagliptina 5 mg para PAS, não significativo para PAD) para Glyxambi® 10 mg/5 mg. [4]
Após 24 semanas foi utilizada terapia de resgate em 1 (0,7%) paciente tratado com Glyxambi® 25mg/5mg e em 3 (2,2%) pacientes tratados com Glyxambi® 10 mg/5 mg, em comparação a 4 (3,1%) pacientes tratados com linagliptina 5 mg, 6 (4,3%) pacientes tratados com empagliflozina 25 mg e 1 (0,7%) paciente tratado com empagliflozina 10 mg. [4]
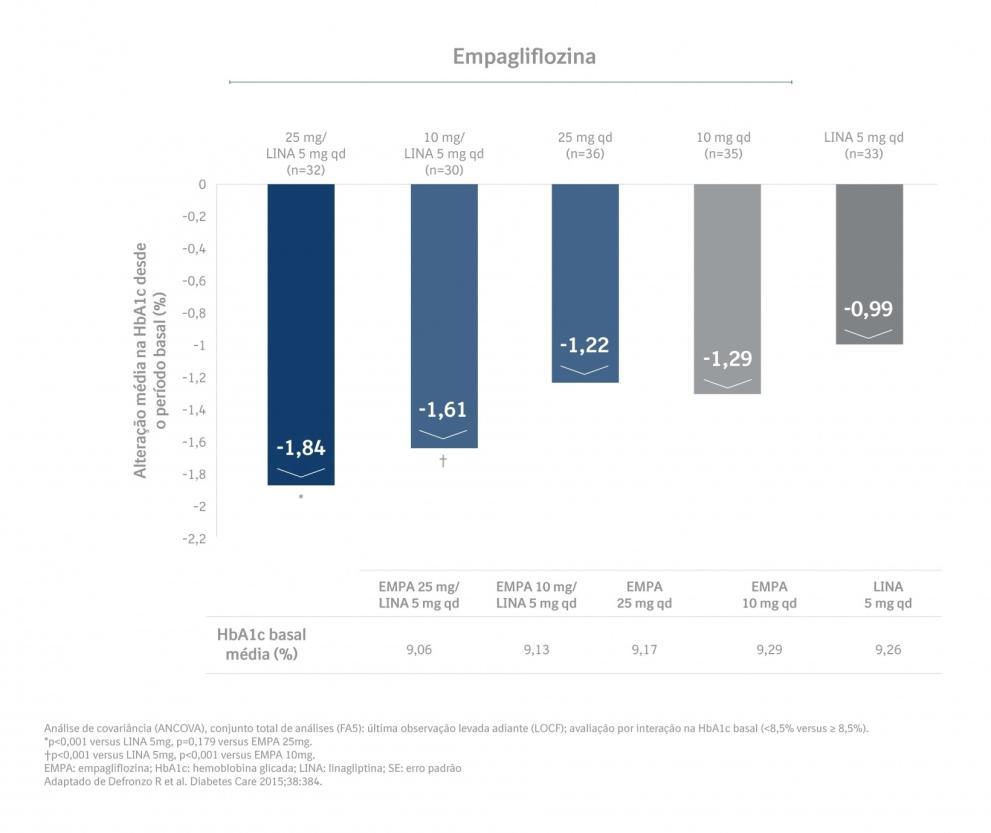
Em um subgrupo pré-especificado de pacientes com HbA1c basal maior ou igual a 8,5%, a redução a partir do período basal na HbA1c com Glyxambi® 25 mg/5 mg foi de -1,8% em 24 semanas (p<0,0001 versus linagliptina 5 mg, p<0,001 versus empagliflozina 25 mg) e -1,8% em 52 semanas (p<0,0001 versus linagliptina 5 mg, p<0,05 versus empagliflozina 25 mg) e, com Glyxambi® 10 mg/ 5 mg, -1,6% em 24 semanas (p<0,01 versus linagliptina 5 mg, n.s. versus empagliflozina 10 mg) e -1,5% em 52 semanas (p<0,01 versus linagliptina 5 mg, n.s. versus empagliflozina
10 mg). [4]
Referências
-
Bula profissional de Glyxambi® (empagliflozina + linagliptina). Versão aprovada pela ANVISA em 12 de Junho de 2024. Disponível em: https://consultas.anvisa.gov.br/#/bulario/q/?nomeProduto=GLYXAMBI.
-
Seufert J, Naderali E, Maldonado M, et al. Empagliflozin as Add-on to Linagliptin and Metformin in Patients with Type 2 Diabetes (T2DM): Subgroup Analysis by Baseline Demographics in a 24- Week Randomized Trial. Diabetes.2016;65(Suppl 1):A292.
-
Gerich JE. Role of the kidney in normal glucose homeostasis and in the hyperglycaemia of diabetes mellitus: therapeutic implications. Diabet Med. 2010;27(2):136-42.
-
Defronzo RA, Lewin A, Patel S, et al. Combination of empagliflozin and linagliptin as second-line therapy in subjects with type 2 diabetes inadequately controlled on metformin. Diabetes Care. 2015;38(3):384-93.
Minibula
GLYXAMBI®
CONTRAINDICAÇÃO: GLYXAMBI é contraindicado em pacientes com hipersensibilidade à empagliflozina ou à linagliptina, ou a qualquer um dos excipientes, e em pacientes com insuficiência renal grave (TFGe < 30 mL/min/1,73m2), incluindo pacientes em diálise. A experiência terapêutica de Glyxambi em pacientes com comprometimento renal grave é limitada.
INTERAÇÕES MEDICAMENTOSAS: Não foram observadas interações clinicamente significativas na farmacocinética de outros medicamentos comumente utilizados quando a empagliflozina ou a linagliptina foram concomitantemente administradas.
GLYXAMBI - Comprimidos revestidos de 10 mg/5 mg ou Comprimidos revestidos de 25 mg/5 mg - empagliflozina e linagliptina - Indicações: é indicado para melhorar o controle glicêmico em adultos com diabetes mellitus tipo 2, associado ao tratamento com metformina, dieta e exercícios físicos. GLYXAMBI pode ser usado como tratamento inicial em pacientes não elegíveis ao tratamento com metformina. Dosagem e Administração: A dose inicial recomendada de GLYXAMBI é 10 mg/5mg (empagliflozina 10 mg/ linagliptina 5 mg), uma vez ao dia. A dose pode ser aumentada para GLYXAMBI 25 mg/5 mg (empagliflozina 25 mg/ linagliptina 5 mg), uma vez ao dia, no caso de pacientes que toleram GLYXAMBI 10 mg/5mg uma vez ao dia e que requerem controle glicêmico adicional. GLYXAMBI pode ser ingerido com ou sem alimento. GLYXAMBI é contraindicado para uso em pacientes com comprometimento renal com TFGe <30 mL/min/1,73 m2, incluindo pacientes em diálise. A experiência terapêutica de GLYXAMBI em pacientes com comprometimento renal grave é limitada. Não é necessário ajuste de dose para pacientes com TFGe ≥30mL/min/1,73m2. Não é recomendado ajuste de dose para pacientes com comprometimento hepático. Não é recomendado ajuste de dose com base na idade. A experiência terapêutica em pacientes com 75 anos ou mais é limitada e o início da terapia com GLYXAMBI nesta população não é recomendado. GLYXAMBI não é recomendado para uso em pacientes com menos de 18 anos de idade. Contraindicações: GLYXAMBI é contraindicado em pacientes com hipersensibilidade à empagliflozina ou à linagliptina, ou a qualquer um dos excipientes, e em pacientes com insuficiência renal grave (TFGe < 30 mL/min/1,73m2), incluindo pacientes em diálise. A experiência terapêutica de Glyxambi em pacientes com comprometimento renal grave é limitada. Advertências e precauções: GLYXAMBI não deve ser usado em pacientes com diabetes mellitus tipo 1. GLYXAMBI deve ser usado com cautela em pacientes com risco para cetoacidose diabética. Deve-se ter cuidado ao reduzir a dose de insulina. Em pacientes tratados com GLYXAMBI, deve-se considerar o monitoramento da cetoacidose e a descontinuação temporária do GLYXAMBI em situações clínicas conhecidas por predispor à cetoacidose (por exemplo, jejum prolongado devido a doença aguda ou cirurgia). Nessas situações, considere o monitoramento de cetonas, mesmo que o tratamento com GLYXAMBI tenha sido interrompido. Houve relatos pós-comercialização de pancreatite aguda por pacientes que utilizaram a linagliptina. Se houver suspeita de pancreatite, deve-se descontinuar o tratamento com GLYXAMBI. Aconselha-se cautela com uso de GLYXAMBI em combinação com agentes que são conhecidos por causar hipoglicemia, como sulfonilureias e insulinas; uma redução na dose da sulfonilureia ou insulina pode ser considerada. Em condições clínicas agudas nas quais haja um declínio significativo da função renal, a manutenção clínica do tratamento com GLYXAMBI deve ser avaliada. Devido ao seu mecanismo de ação, a eficácia de empagliflozina é dependente da função renal. Portanto, é recomendada a avaliação da função renal antes do início do tratamento com GLYXAMBI e periodicamente durante o tratamento, pelo menos anualmente. No caso de condições que podem levar a perda hídrica (por exemplo, doenças gastrointestinais), monitoramento cuidadoso da volemia (por exemplo, avaliação física, medições de pressão arterial, exames laboratoriais incluindo hematócrito) e de eletrólitos é recomendado para os pacientes que recebem empagliflozina e dessa forma, interrupção temporária do tratamento com GLYXAMBI deve ser considerada até que a perda hídrica seja corrigida. Houve relatos pós- comercialização de penfigoide bolhoso em pacientes que tomaram linagliptina. Se houver suspeita de penfigoide bolhoso, GLYXAMBI deve ser descontinuado. Foram relatados também casos pós- comercialização de fasciite necrosante do períneo, uma infecção rara, porém grave e com risco de vida, em pacientes com diabetes em uso de inibidores de SGLT2, incluindo empagliflozina. Se sintomas de hiperemia dor ou sensibilidade, vermelhidão, inchaço na região ao redor dos órgãos genitais, glúteos, virilha e/ou ânus, febre e mal-estar, o GLYXAMBI deve ser descontinuado e o tratamento iniciado imediatamente. Interações medicamentosas: Não foram observadas interações clinicamente significativas na farmacocinética de outros medicamentos comumente utilizados quando a empagliflozina ou a linagliptina foram concomitantemente administradas. Fertilidade, gravidez e lactação: categoria B de risco na gravidez. Não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista. Recomenda-se descontinuar a amamentação durante o tratamento com GLYXAMBI. Não foram conduzidos estudos sobre o efeito na fertilidade humana para GLYXAMBI ou suas substâncias ativas individuais. Reações Adversas: O efeito colateral mais frequente foi infecção do trato urinário. Em geral, o perfil de segurança de GLYXAMBI foi comparável aos perfis de segurança das substâncias ativas individuais (empagliflozina e linagliptina). As reações adversas ao medicamento apresentadas abaixo são baseadas nos perfis de segurança da monoterapia com empagliflozina e linagliptina, e também foram relatadas nos estudos clínicos e experiências pós-comercialização com GLYXAMBI. Nenhum efeito adverso adicional foi identificado com GLYXAMBI em comparação com as substâncias ativas individuais. Classificação das reações adversas por frequência para GLYXAMBI 10 mg/5 mg (empagliflozina/linagliptina): Reações comuns: monilíase vaginal, vulvovaginite, balanite e outras infecções genitais, infecção do trato urinário, nasofaringite, hipoglicemia (quando usado com sulfonilureia ou insulina), aumento da micção, tosse, rash, lipase e amilase aumentadas e aumento dos lipídeos séricos. Reações incomuns: hipersensibilidade, urticária, prurido, disúria, pancreatite, hipovolemia e taxa de filtração glomerular diminuída. Reações de frequência desconhecida: angioedema, cetoacidose, ulceração da boca, sede, aumento da creatinina sérica, aumento do hematócrito e penfigoide bolhoso. Classificação das reações adversas por frequência para GLYXAMBI 25 mg/5 mg (empagliflozina/linagliptina): Reações comuns: monilíase vaginal, vulvovaginite, balanite e outras infecções genitais, infecção do trato urinário, nasofaringite, hipoglicemia (quando usado com sulfonilureia ou insulina), aumento da micção, tosse, prurido, lipase aumentada e aumento dos lipídeos séricos. Reações incomuns: hipersensibilidade, angioedema, disúria, rash, hipovolemia, sede, aumento da creatinina sérica e taxa de filtração glomerular diminuída amilase aumentada. Reação de frequência desconhecida: urticária, cetoacidose, pancreatite, ulceração da boca, aumento do hematócrito, penfigoide bolhoso e fasciite necrosante do períneo (gangrena de Fournier). Nº de registro: 10 MG + 5 MG COM REV CT BL AL PLAS TRANS X 10 - MS1.0367.0176.001-6; 10 MG + 5 MG COM REV CT BL AL PLAS TRANS X 30 - MS 1.0367.0176.002-4; 25 MG + 5 MG COM REV CT BL AL PLAS TRANS X 10 - MS 1.0367.0176.003-2; 25 MG + 5 MG COM REV CT BL AL PLAS TRANS X 30 - MS 1.0367.0176.004-0; SAC 0800 701 663. VENDA SOB PRESCRIÇÃO MÉDICA. Em casos de eventos adversos, notifique pelo Sistema VigiMed, disponível no Portal da Anvisa.


